Effectiviteit van een neuroplasticiteitsbehandeling bij post-COVID
Achtergrond: Post-COVID gaat vaak gepaard met aanhoudende cognitieve en fysieke klachten die het dagelijks functioneren belemmeren. NeuroRC ontwikkelde een neuroplasticiteitstraining voor mensen met post-COVID.
Doelstelling: Deze studie onderzocht de effectiviteit van het behandelprogramma bij individuen met post-COVID klachten op het gebied van symptoomlast, kwaliteit van leven, executief functioneren, werkvermogen, en hartslagvariabiliteit.
Methode: In totaal namen 49 cliënten met post-COVID deel aan het programma. Voor en na de interventie werden meerdere vragenlijsten afgenomen, waaronder de SCAT5 Symptoomevaluatie, Quality of Life after Brain Injury (QOLIBRI), de Work Ability Index (WAI) en het executief functioneren (DEX). Daarnaast werd de hartslagvariabiliteit (HRV) gemeten. Veranderingen in symptoomlast en functioneren werden geëvalueerd met behulp van gepaarde t-toetsen en effectgroottes. Dit betreft een tussentijdse analyse van een lopend onderzoek; behandelingen en dataverzameling zijn nog gaande.
Resultaten: De gemiddelde symptoomernst nam significant af tussen baseline en week 12 (gemiddelde afname: -34.4 punten; p < .001, Cohen’s d = -1.92). Op de QOLIBRI werd eveneens een significante verbetering waargenomen: de gemiddelde totaalscore steeg van 48.6 bij baseline naar 69.6 in week 12 (gemiddeld verschil = 21 punten; p < .001, Cohen’s d = 1.47). Deelnemers werkten voorafgaand aan de behandeling gemiddeld 10.6 uur per week; circa één jaar na het traject was dit toegenomen tot gemiddeld 19.9 uur per week.
Conclusie: Het behandelprogramma van NeuroRC laat veelbelovende effecten zien op symptoomvermindering en dagelijks functioneren bij cliënten met post-COVID. Deze resultaten onderstrepen het potentieel van intensieve, neuroplasticiteitsgerichte interventies voor deze doelgroep.
Er wordt nog actief aan gewerkt en sommige onderdelen zijn mogelijk (nog) niet volledig of definitief. Laatste bijgewerkte versie: december 2025.
1 Introductie
Post-COVID wordt doorgaans gedefinieerd als klachten die optreden bij mensen met een bevestigde of waarschijnlijke SARS-CoV-2-infectie, meestal vanaf 3 maanden na het begin van de acute infectie, die minimaal 2 maanden aanhouden en niet (beter) verklaard worden door een alternatieve diagnose [1]. De gerapporteerde prevalentie varieert sterk afhankelijk van definitie, meetmoment en bronpopulatie. Grootschalige populatiestudies wijzen echter consistent op een substantiële ziektelast; zo rapporteerde een recente, prospectieve populatiecohortstudie dat 23% van de geïnfecteerden voldeed aan een long-coviddefinitie, en dat bij circa de helft van deze groep klachten tot twee jaar aanhielden [2]. In Nederland is de omvang van post-COVID eveneens aanzienlijk. De schatting is dat er circa 450.000 mensen met langdurige klachten na COVID-19 zijn, van wie ongeveer 90.000 ernstig beperkt zijn in participatie [3]. Deze schattingen sluiten aan bij de periodieke RIVM-monitoring, waarin 2,6% van de volwassenen aangeeft op dat moment post-COVID klachten te hebben (naast een substantiële groep die inmiddels hersteld is). Onder jongeren is dit percentage nog hoger; 3,4% van de jongeren rapporteert post-COVID klachten [4]. Samen onderstrepen deze gegevens dat het om een substantieel deel van de bevolking gaat.
Post-COVID kan leiden tot ernstige beperkingen in het dagelijks functioneren en maatschappelijke participatie: 67% van de mensen met post-COVID rapporteren zich matig tot veel beperkt te voelen [4]. Daarnaast raakt post-COVID de arbeidsparticipatie: 33% van de mensen met post-COVID rapporteert minder of niet te werken vanwege post-COVID klachten [4].
Klinisch gaat het vaak om aanhoudende symptomen zoals (post-exertionele) vermoeidheid, cognitieve klachten (“brain fog”), overprikkeling, slaapstoornissen, pijn en autonome klachten (bijv. palpitaties/duizeligheid) [5]. Ondanks de hoge ziektelast bestaat er nog geen wereldwijd geaccepteerde, evidence-based behandeling voor post-COVID die curatief van aard is; de zorg is veelal symptoomgericht en multidisciplinair, met onder meer paramedische begeleiding (fysiotherapie/revalidatie), psychologische interventies, en waar passend medicamenteuze symptoombehandeling. De heterogeniteit van het klachtenbeeld en (pathofysiologische) onderliggende mechanismen—zoals aanwijzingen voor immuundysregulatie, autonome dysfunctie en veranderingen in het microbioom—bemoeilijkt de ontwikkeling en evaluatie van interventies [5]. Tegen deze achtergrond evalueren wij een gepersonaliseerd, multidisciplinair behandeltraject dat is opgebouwd uit (1) een voortraject, waarbij een sporenonderzoek (bloed/speeksel), een darmmicrobioomonderzoek (DMB), en een 3-daagse stressmeting (HRV) wordt gevolgd door (2) een multidisciplinair overleg met GZ-psycholoog, sportpsycholoog, medisch microbioloog, (huis)arts, diëtist en fysiotherapeut. Op basis hiervan worden de vermoedelijk dominante pathofysiologische routes per cliënt gewogen en worden geïndividualiseerde leefstijl- en herstelinterventies ingezet ter optimalisatie van belastbaarheid en herstelcondities. Daarnaast krijgen alle deelnemers informatie over voeding, bewegen, ademhaling, slaap/rust, stress(mindset) en groeimindset als voorbereiding op deelname aan een (3) intensieve neuroplasticiteitstraining. De veronderstelde werkingsmechanismen sluiten aan bij beschreven post-COVID hypothesen: (a) modulatie van autonome dysregulatie (o.a. via HRV-gestuurde rust- en activatieritmes), (b) beïnvloeding van darm-brein-as en energie-/ontstekingsroutes via DMB-gestuurde voedingsadviezen bij dysbiose, en (c) verbetering van cognitieve en functionele klachten via neuroplasticiteitsprincipes, exposure aan prikkels en gesuperviseerde opbouw van belasting binnen individuele grenzen [5].
In dit artikel beschrijven we de uitkomsten van 49 deelnemers die op eigen initiatief tussen oktober 2022 en december 2025 het multidisciplinaire post-COVID behandeltraject bij NeuroRC volgden. We analyseren de verandering in hun functioneren aan de hand van metingen op vijf niveaus:
- Cognitieve en fysieke klachten, in kaart gebracht met de SCAT5 vragenlijst (Sport Concussion Assessment Tool) [6];
- Kwaliteit van leven, gemeten met de QOLIBRI vragenlijst (Quality of Life after Brain Injury) [7];
- Werkvermogen, beoordeeld met een aangepaste versie van de Work Ability Index vragenlijst (WAI) [8].
- Executief functioneren, beoordeeld met de Dysexecutive Questionnaire (DEX) [8].
- Hartslagvariabiliteit (HRV), gemeten met Firstbeat Life™ BodyGuard2 [9].
2 Resultaten
2.1 Selectiecriteria post-COVID groep
De populatie betreft mensen die op eigen initiatief de behandeling bij NeuroRC ondergingen naar aanleiding van aanhoudende klachten na een COVID-19 besmetting. De behandeling wordt beschreven in Paragraaf 4.1. De uiteindelijke analysegroep bestaat uit deelnemers die een geldige voor- en nameting hebben ingevuld voor ten minste één van de onderstaande vragenlijsten.
Symptoomevaluatie (SCAT5):
De deelnemer heeft deze vragenlijst ingevuld in week 1, én minstens één geldige meting na de intensieve behandelweek, dus in week 4, 5, 6, 7, 12, 24, 48 of 96 (post-meting).
Kwaliteit van leven (QOLIBRI):
De deelnemer heeft deze vragenlijst ingevuld in week 1, én minstens één geldige meting na de behandelweek in week 4, 5, 6, 7, 12, 24, 48 of 96.
Work Ability Index (WAI):
De deelnemer heeft deze vragenlijst ingevuld in week 1, én minstens één geldige meting na de behandelweek in week 24 of 48.
Executief functioneren (DEX):
De deelnemer heeft deze vragenlijst ingevuld in week 1 en in week 12.
Executief functioneren ingevuld door naaste van de deelnemer (DEX naaste):
De naaste van de deelnemer heeft deze vragenlijst ingevuld in week 1 en in week 12.
Hartslagvariabiliteit (HRV):
De deelnemer heeft minimaal 2/3 van de geplande HRV-metingen in zowel week 1 en in week 12.
De uiteindelijke analysegroep bestaat dus uit alle deelnemers die een geldige voor- én nameting hebben bij ten minste één van de voorgenoemde vragenlijsten en metingen. In de rapportage wordt per vragenlijst of meting afzonderlijk:
een demografisch overzicht gegeven, en
het aantal deelnemers gerapporteerd dat aan de voorgenoemde voorwaarden voldoet.
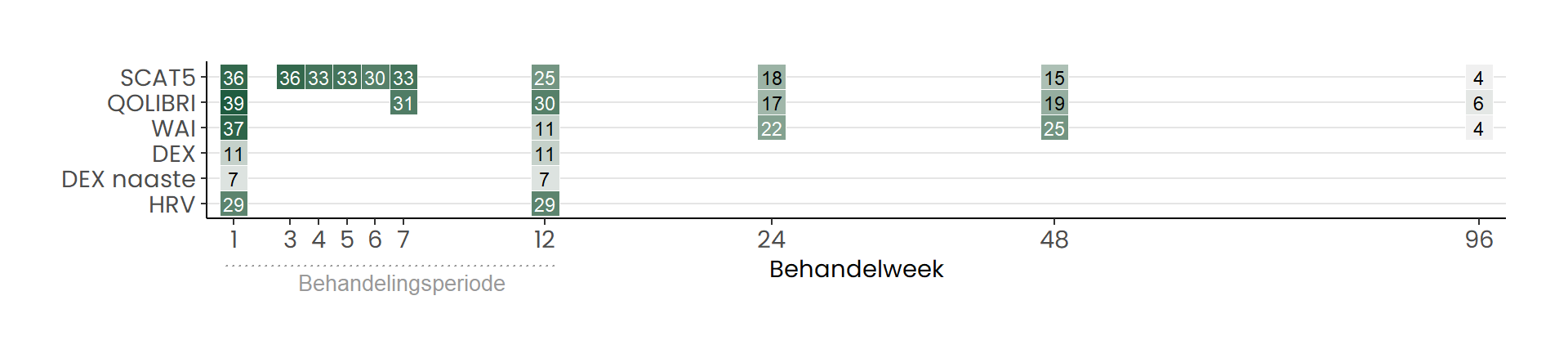
Van de 57 patiënten met de diagnose post-COVID in het patiëntenbestand, voldeden 49 deelnemers aan de inclusiecriteria voor ten minste één van de vragenlijsten (SCAT5, QOLIBRI, WAI, DEX, DEX-naaste, HRV). In de rapportage wordt voor elke vragenlijst afzonderlijk een demografisch overzicht en het specifieke aantal deelnemers gegeven. Het aantal deelnemers dat aan de criteria voor elke vragenlijst voldeed, is als volgt:
Symptoomevaluatie (SCAT5): 36 deelnemers (Tabel 7),
Kwaliteit van leven (QOLIBRI): 39 deelnemers (Tabel 8)
Work Ability Index (WAI): 37 deelnemers (Tabel 9)
Executief functioneren (DEX): 11 deelnemers (Tabel 10)
Executief functioneren (DEX naaste): 7 deelnemers (Tabel 11)
Hartslagvariabiliteit (HRV) 29 deelnemers (Tabel 12)
Figuur 1 toont een overzicht van het aantal cliënten per ingevulde vragenlijst, uitgesplitst naar behandelweek.

2.1.1 Demografische kenmerken van de geïncludeerde cliënten
De demografische kenmerken van de deelnemers die voldoen aan de gestelde inclusiecriteria voor minstens één van de metingen (SCAT5, QOLIBRI, WAI, DEX, DEX-naaste, HRV) staan weergegeven in Tabel 1. Ontbrekende gegevens zijn voornamelijk het gevolg van het niet invullen van vragenlijsten door deelnemers, of van administratieve veranderingen zoals het overstappen naar een nieuw dataverzamelingssysteem gedurende de onderzoeksperiode. De onderzochte populatie bestond uit 49 personen met post-COVID die een behandeltraject bij NeuroRC volgden. De meerderheid was vrouw (71.4%), met een gemiddelde leeftijd van 41.5 jaar (SD = 12.2) bij aanvang van de behandeling. Gemiddeld waren er 2.2 jaar verstreken sinds de COVID-19 besmetting (SD = 1.4).
Er was sprake van een lichte oververtegenwoordiging van hoogopgeleiden. Van de deelnemers had 32.7% als hoogste afgeronde opleiding een hbo- of wo-bachelordiploma, en 20.4% had een masterdiploma of promotietraject voltooid. Daarnaast had 24.5% als hoogste opleiding een havo-, vwo- of mbo-diploma, en 2% had maximaal een vmbo-opleiding of lager afgerond. Van 20.4% was het opleidingsniveau onbekend.
Deelnemers volgden verschillende behandelprogramma’s binnen de instelling. Een derde (22.4%) nam deel aan het volledige behandelprogramma, bestaande uit een intensieve behandelweek, boosterdagen en mild hyperbare zuurstoftherapie (mHBOT). Een iets kleinere groep (24.5%) volgde het programma zonder mHBOT. Voor de overige circa een derde van de deelnemers is niet gedocumenteerd welke specifieke variant van het behandelprogramma zij hebben gevolgd. Belangrijk hierbij is dat mHBOT vanaf november 2024 niet langer deel uitmaakte van het behandelprogramma.
Van de 49 deelnemers had 16.3% eerder al contact gehad met eerstelijnszorg: 8.2% volgde fysiotherapie, 6.1% kreeg ergotherapie, en 4.1% had psychologische begeleiding ontvangen. Daarnaast rapporteerde 2% een eerdere revalidatiebehandeling in poliklinische setting.
| Subcategorie | Eigenschap | Niveau | N (%) | Gemiddelde (SD) |
|---|---|---|---|---|
| Demografische gegevens | Geslacht | Vrouwelijk | 35 (71.4%) | |
| Mannelijk | 14 (28.6%) | |||
| Leeftijd bij start behandeling | 49 (100%) | 41.5 (12.2) | ||
| Opleidingsniveau | Hbo-, wo-bachelor | 16 (32.7%) | ||
| Havo, vwo, mbo2-4 | 12 (24.5%) | |||
| Hbo-, wo-master, doctor | 10 (20.4%) | |||
| Onbekend | 10 (20.4%) | |||
| Vmbo, havo-, vwo-onderbouw, mbo1 | 1 (2%) | |||
| Kenmerken Post-Covid | Type | Post Covid | 33 (67.3%) | |
| Onbekend | 16 (32.7%) | |||
| Jaren sinds besmetting | 34 (69.4%) | 2.2 (1.4) | ||
| Subdiagnose | Onbekend | 33 (67.3%) | ||
| DSQ score wijzend op PEM | 13 (26.5%) | |||
| DSQ score niet wijzend op PEM | 2 (4.1%) | |||
| Chronisch vermoeidheidssyndroom (ME/CVS) | 1 (2%) | |||
| Behandeling | Behandeling NeuroRC | Onbekend | 26 (53.1%) | |
| Intensieve week + boosterdagen | 12 (24.5%) | |||
| Intensieve week + mHBOT + boosterdagen | 11 (22.4%) | |||
| Behandelgeschiedenis | Gevolgde behandelingen | Onbekend | 41 (83.7%) | |
| Eerste lijns fysiotherapie | 4 (8.2%) | |||
| Eerste lijns ergotherapie | 3 (6.1%) | |||
| Behanding bij een 2e lijns GGZ instelling of psychiater | 2 (4.1%) | |||
| Eerste lijns psycholoog | 2 (4.1%) | |||
| Revalidatie poliklinisch | 1 (2%) |
2.2 Symptoomlast (SCAT5)
Voor het in kaart brengen van cognitieve en fysieke klachten maakten we gebruik van de SCAT5 Symptom Evaluation ([6]), een vragenlijst waarbij deelnemers 22 hersenschudding-gerelateerde symptomen beoordelen op een schaal van 0 (geen last) tot 6 (ernstige last). Deze symptomen omvatten onder andere hoofdpijn, duizeligheid, vermoeidheid, concentratieproblemen en overgevoeligheid voor licht of geluid. De somscore van alle items – aangeduid als de ernstscore – varieert van 0 tot 132, waarbij hogere scores wijzen op meer en/of ernstigere klachten. In gezonde populaties worden doorgaans lage ernstscores gerapporteerd (gemiddeld 7,9; [10]).
De SCAT5-symptoomevaluatie is niet specifiek gevalideerd voor post-COVID-patiënten. Echter, hersenschuddinggerelateerde symptomen die veel voorkomen bij mensen met niet-aangeboren hersenletsel (NAH), zoals hoofdpijn, vermoeidheid, duizeligheid en concentratieproblemen, overlappen sterk met het klachtenprofiel bij post-COVID. Vanwege het ontbreken van post-COVID-specifieke psychometrische data is voorzichtigheid geboden bij het trekken van absolute conclusies uit totaalscores. De progressie op individuele items biedt echter wel relevante informatie ten aanzien van de effecten van de behandeling op een breed scala aan symptomen in deze heterogene populatie.
De gemiddelde ernstscore op baseline bedroeg 58.3 (sd = 23.9) in week 1. Bij afsluiting van het behandeltraject (week 12) was de gemiddelde afname in symptoomernst ten opzichte van baseline -34.4 punten (sd = 16.4) .
Het verloop van symptoomernst over tijd is weergeven in Figuur 2. Zie Paragraaf 4.2 voor een toelichting op de tijdsaanduidingen op de x-as. Tabel 2 presenteert de gemiddelde SCAT5-totaalscores per behandelweek, inclusief het verschil ten opzichte van baseline. Voor de analyse van veranderingen in scores tussen elk tijdspunt en baseline is gebruikgemaakt van gepaarde t-toetsen.
| Behandelweek | N | Gemiddelde | SD | Verschil t.o.v. baseline | p-waarde | Cohen's d |
|---|---|---|---|---|---|---|
| 1 | 36 | 58.28 | 23.93 | 0.0 | — | — |
| 4 | 33 | 37.58 | 21.94 | -20.7 | 1.19e-06 | -1.04 |
| 12 | 25 | 23.92 | 16.38 | -34.4 | 1.1e-09 | -1.92 |
| 24 | 18 | 30.72 | 22.99 | -27.6 | 3.18e-06 | -1.6 |
| 48 | 15 | 29.53 | 27.84 | -28.7 | 0.000317 | -1.22 |
| 96 | 4 | 39.75 | 46.26 | -18.5 | 0.154 | -0.95 |
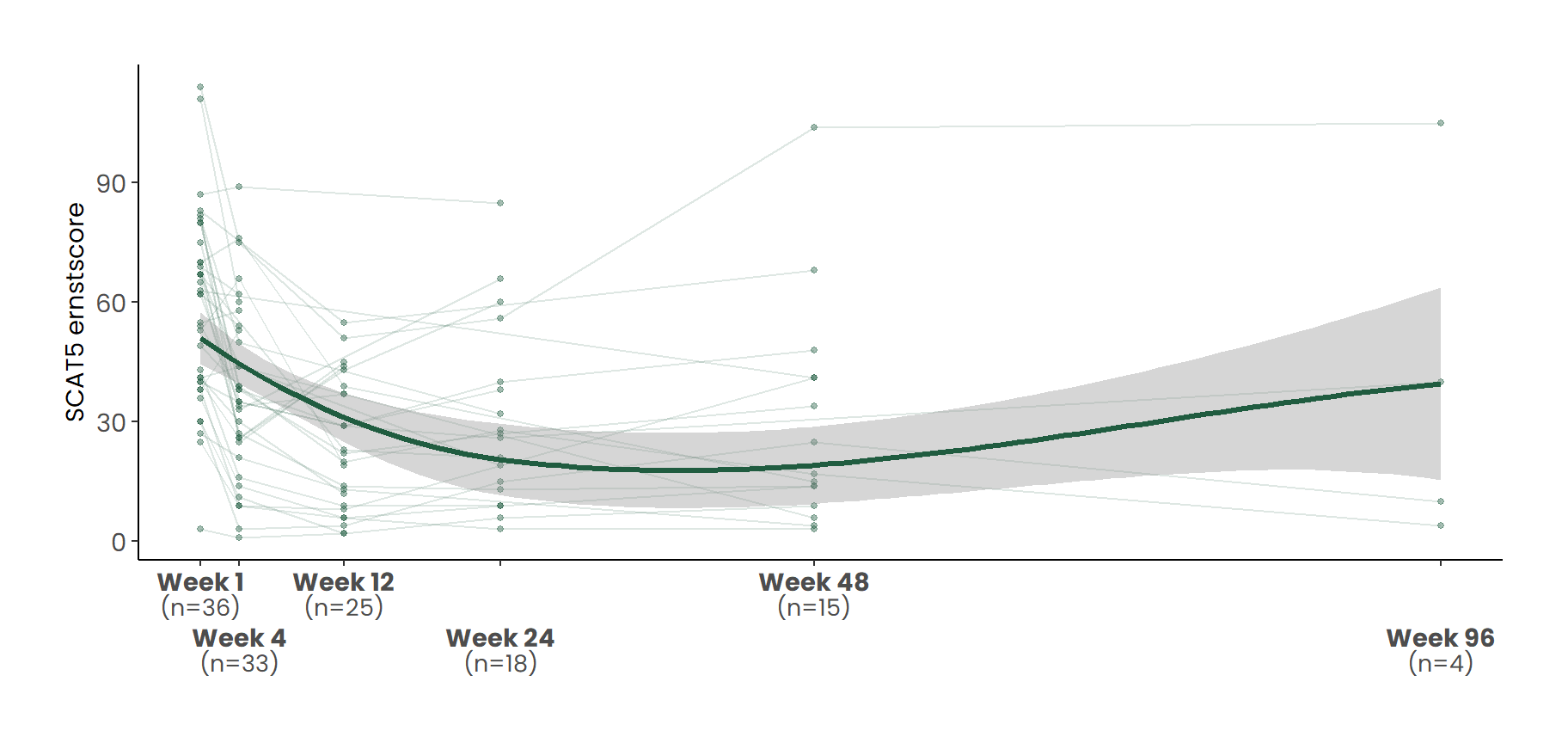
De groene lijn toont een loess-smoothing van het gemiddelde verloop met 95%-betrouwbaarheidsinterval. Alle meetmomenten zijn uitgedrukt ten opzichte van het begin van week 3.
2.3 Work Ability Index (WAI)
De Work Ability Index (WAI) werd ingezet als maat voor de arbeidsinzetbaarheid, zowel voorafgaand aan als op meerdere tijdstippen na afloop van het behandeltraject. In totaal werden bij 37 deelnemers WAI-metingen verzameld op meerdere tijdspunten, waaronder baseline (week 1) en één of meerdere follow-upmomenten (week 24 en 48).
De gebruikte versie van de WAI omvatte zes items, waarmee verschillende dimensies van werkvermogen in kaart werden gebracht (zie Paragraaf 4.3.1: Work Ability Index (WAI)).
2.3.1 Werkvermogen
Het zelfgerapporteerde werkvermogen, gemeten op een schaal van 0 (helemaal niet kunnen werken) tot 10 (volledig werkvermogen), vertoonde een significante toename gedurende de studie. De gemiddelde score bij baseline was 1.6 (SD = 1.8), welke steeg naar 3.7 (SD = 3) na 24 weken en 4.7 (SD = 3.2) bij de follow-up na 48 weken (Figuur Figuur 3).
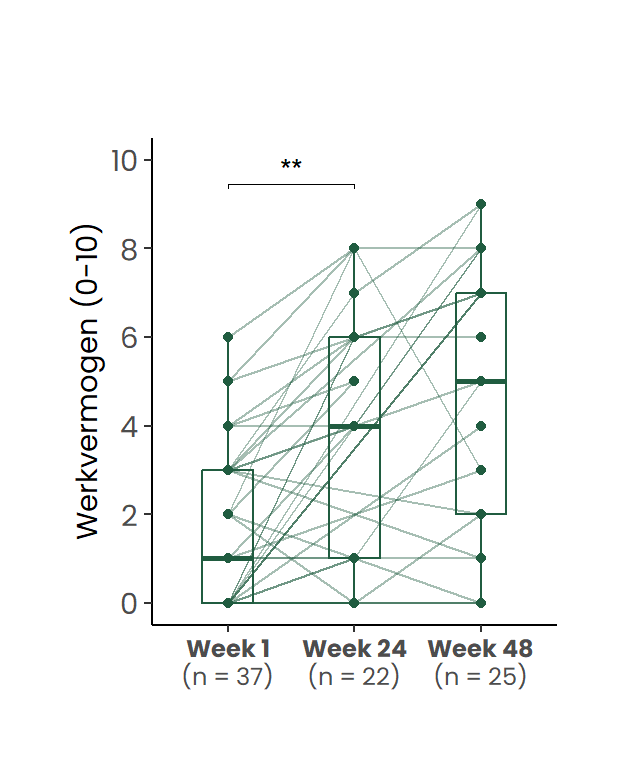
De figuur toont individuele verlooplijnen en de verdeling per tijdstip.
2.3.2 Arbeidsdeelname
Wanneer gestratificeerd werd naar werksituatie op baseline, bleek dat bij de deelnemers die reeds vóór de start van het behandeltraject werkzaam waren (n=13), het gemiddeld aantal gewerkte uren per week toenam van 10.6 uur op week 1, naar 12.4 uur op week 24, en verder naar 19.9 uur op week 48 (Figuur 4 b).
Van de deelnemers die bij aanvang van het traject 0 werkuren rapporteerden (n=24), is voor een deel nog geen follow-up beschikbaar op week 48. Onder degenen voor wie die follow-up wél beschikbaar was, was een meerderheid van 62.5% (gedeeltelijk) teruggekeerd naar werk (Figuur 4 c). Voor de overige deelnemers was mogelijk sprake van een niet-toepasbare werksituatie (zoals pensionering of volledige arbeidsongeschiktheid), of bleek het behandeltraject onvoldoende effectief om het werkvermogen te herstellen.
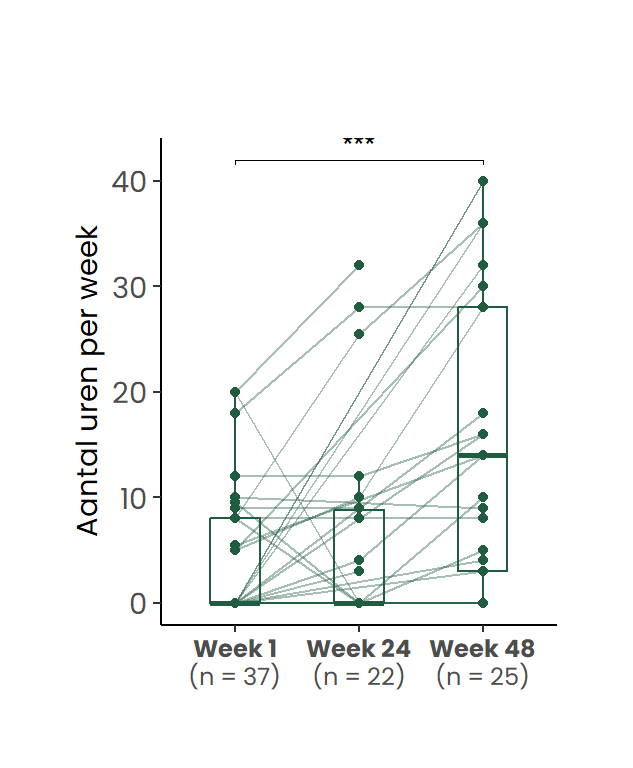
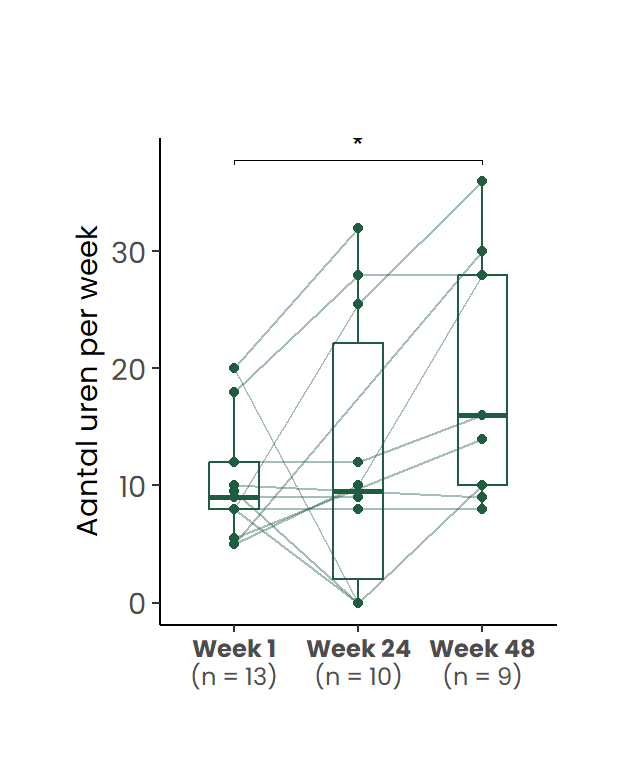
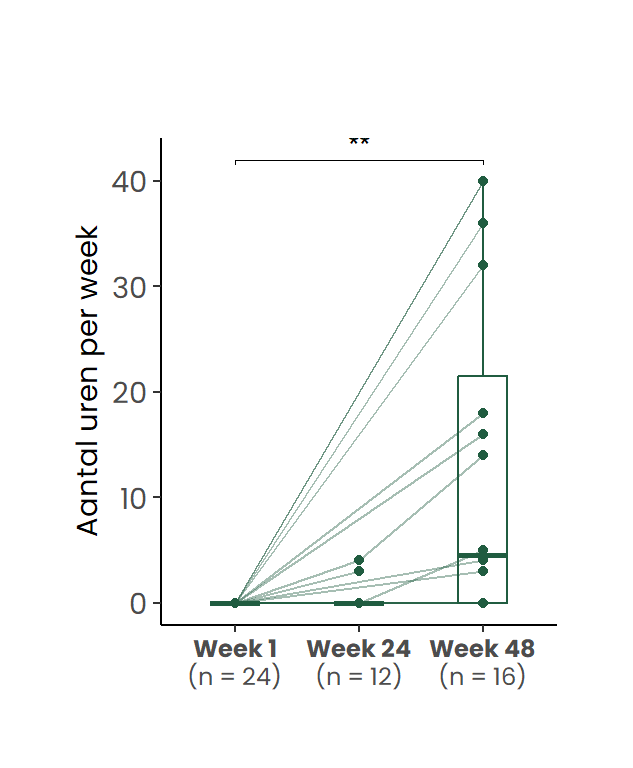
De figuur toont individuele verlooplijnen en de verdeling per tijdstip. (a) gewerkte uren per week. (b) gewerkte uren per week bij cliënten die bij aanvang werkten (week 1 > 0 uur) (c) Gewerkte uren per week bij cliënten die bij aanvang niet werkten (week 1 = 0 uur)
2.4 Kwaliteit van leven (QOLIBRI)
De QOLIBRI (Quality of Life after Brain Injury) is een uitgebreide vragenlijst bestaande uit 37 items, verdeeld over zes dimensies van kwaliteit van leven na hersenletsel. De vragenlijst levert zowel een profielscore per dimensie als een totaalscore op. Dit resulteert in scores waarbij 0 de slechtst mogelijke en 100 de best mogelijke kwaliteit van leven vertegenwoordigt. De mediane QOLIBRI-referentiescores voor de Nederlandse bevolking (leeftijdscategorie 41–64 jaar) variëren van 83 voor gezonde individuen tot respectievelijk 69 en 71 voor mannen en vrouwen met ten minste één chronische aandoening [11].
De QOLIBRI vragenlijst is ook gevalideerd bij gezonde mensen en mensen met een chronische aandoening. Hoewel niet specifiek ontworpen voor mensen met post-COVID, achten wij deze vragenlijst beter geschikt om kwaliteit van leven te meten in deze doelgroep ten opzichte van een meer algemene vragenlijst van kwaliteit van leven, zoals de EQ-5D of SF-36, omdat de domeinspecifieke structuur uit de QOLIBRI beter aansluit bij het neuropsychologische klachtenbeeld van de doelgroep.
In de onderzoeksgroep bedroeg de gemiddelde QOLIBRI-score bij aanvang (week 1) 48.6 (SD = 13). Drie weken na de intensieve behandelweek, in week 7, was deze gestegen naar 63.3, wat neerkomt op een toename van 14.7 punten ten opzichte van de beginsituatie.
Figuur 5 geeft een overzicht van de ontwikkeling van de QOLIBRI-scores over de tijd.
Tabel 3 presenteert de gemiddelde QOLIBRI-totaalscores per behandelweek, inclusief het verschil ten opzichte van baseline. Voor de analyse van veranderingen in scores tussen elk tijdspunt en week 1 is gebruikgemaakt van gepaarde t-toetsen.
| Behandelweek | N | Gemiddelde | SD | Verschil t.o.v. week 1 | p-waarde | Cohen's d |
|---|---|---|---|---|---|---|
| 1 | 39 | 48.64 | 13.02 | — | — | — |
| 7 | 31 | 63.33 | 15.16 | 14.7 | 2.78e-07 | 1.18 |
| 12 | 30 | 69.61 | 15.88 | 21 | 7.26e-09 | 1.47 |
| 24 | 17 | 70.91 | 16.63 | 22.3 | 0.000195 | 1.16 |
| 48 | 19 | 69.77 | 17.96 | 21.1 | 4.18e-06 | 1.49 |
| 96 | 6 | 65.20 | 22.68 | 16.6 | 0.0198 | 1.38 |
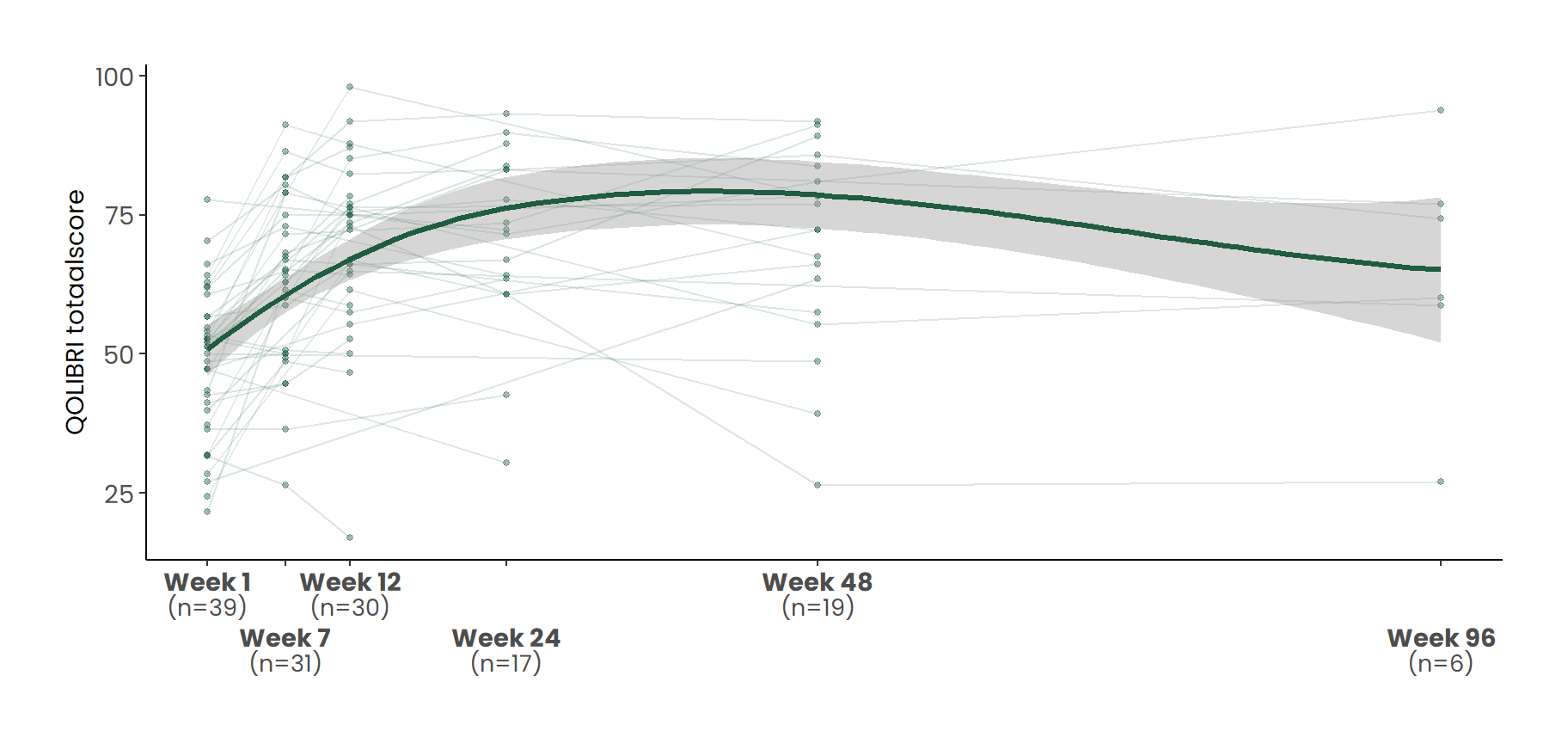
De groene lijn toont een loess-smoothing van het gemiddelde verloop met 95%-betrouwbaarheidsinterval.
2.5 Executief functioneren (DEX)
De Dysexecutive Questionnaire (DEX) werd ingevuld door de deelnemers zelf en door een door hen aangewezen naaste. De vragenlijst bestaat uit 20 items met een 5-puntsschaal (0 = nooit tot 4 = heel vaak). De totaalscore varieert van 0 tot 80, waarbij hogere scores wijzen op meer executieve klachten. Metingen zijn verricht in week 1 (baseline) en week 12 (einde behandeling). Van 11 deelnemers waren zowel een baseline- als een eindmeting beschikbaar, en voor 7 deelnemers was daarnaast ook een DEX-naaste ingevuld. Figuur 6 toont de gemiddelde scores van de 20 DEX-items in behandelweek 1 en 12. Tabel 4 presenteert de gemiddelde DEX-totaalscores per behandelweek, inclusief het verschil ten opzichte van baseline. Voor de analyse van veranderingen in scores tussen elk tijdspunt en baseline is gebruikgemaakt van gepaarde t-toetsen.
| Behandelweek | N | Gemiddelde | SD | Verschil t.o.v. week 1 | p-waarde | Cohen's d |
|---|---|---|---|---|---|---|
| 1 | 11 | 22.18 | 11.44 | 0.0 | — | — |
| 12 | 11 | 17.36 | 11.71 | -4.8 | 0.221 | -0.39 |

Tabel 5 presenteert de gemiddelde DEX-naaste totaalscores per behandelweek, inclusief het verschil ten opzichte van baseline. Voor de analyse van veranderingen in scores tussen elk tijdspunt en baseline is gebruikgemaakt van gepaarde t-toetsen.
| Behandelweek | N | Gemiddelde | SD | Verschil t.o.v. week 1 | p-waarde | Cohen's d |
|---|---|---|---|---|---|---|
| 1 | 7 | 18.29 | 13.82 | 0 | — | — |
| 12 | 7 | 14.29 | 10.70 | -4 | 0.0833 | -0.78 |
2.6 Hartslagvariabiliteit (HRV)
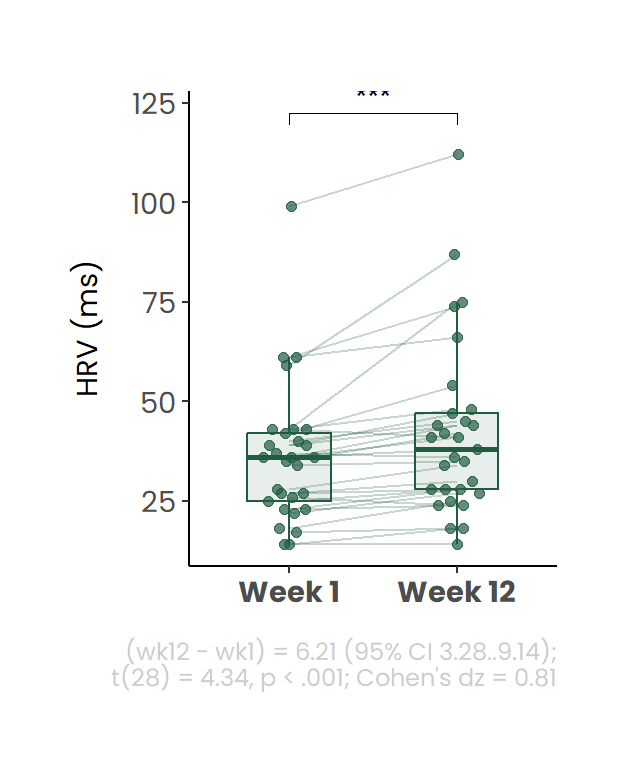
Hartslagvariabiliteit (HRV; RMSSD-gebaseerd) werd gemeten met de Firstbeat Life™ BodyGuard2 [9], een draagbare ECG-based recorder met borstelektroden die het R–R-interval continu registreert. Metingen vonden plaats gedurende drie opeenvolgende dagen in week 1 en opnieuw gedurende drie opeenvolgende dagen in week 12. HRV werd per etmaal gedurende de slaap berekend en voor de analyses werd het gemiddelde van deze drie dagen gebruikt (Figuur 7). De gemiddelde HRV nam toe van 36 in week 1 (baseline) naar 42 in week 12 (afsluiting behandeling). Dit verschil was statistisch significant (p = 0.00017).
3 Discussie
In dit manuscript presenteren we de uitkomsten van een op neuroplasticiteit gericht behandelprogramma bij mensen met post-COVID, met week 12 als primair evaluatiemoment en week 1 als baseline.
Op de SCAT5 nam de gemiddelde symptoomlast sterk af ten opzichte van baseline (Δ = -34.4 punten op week 12, d = -1.92; p 1.1e-09). Belangrijk is dat de daling in klachten ook zichtbaar blijft op latere meetmomenten (bijv. week 24 (-27.6 punten) en week 48 (-28.7 punten)), met kleinere steekproeven.
Levenskwaliteit na hersenletsel (QOLIBRI) verbeterde gemiddeld met +21 punten (0–100 schaal) in week 12 (d = 1.47; p = 7.26e-09) en bleef verhoogd in week 24 (+22.3) en 48 (+21.1).
Voor executief functioneren zagen we parallelle dalingen op de DEX (zelfrapportage; Δ = -4.8; d = -0.39; p = 0.221) en op de DEX-naaste (proxy; Δ = -4; d = -0.78; p = 0.0833) in week 12. De convergentie tussen zelf- en naastebeoordeling versterkt de geloofwaardigheid van het signaal dat het dagelijks executief functioneren is verbeterd, hoewel de resultaten voor de DEX en DEX-naaste geïnterpreteerd moeten worden in het licht van de beperkte N voor deze maat (N = 11).
Ten aanzien van arbeidsinzetbaarheid (WAI) en werkparticipatie zien we een stijgende lijn. Bij deelnemers die bij start al werkten (n = 13) namen de gewerkte uren toe (10.6 → 12.4 → 19.9 uur per week; week 1, 24, 48). Onder deelnemers die op baseline 0 uur werkten (n = 24) en voor wie week 48-data beschikbaar zijn, keerde 62.5% (gedeeltelijk) terug naar werk. Deze laatste proportie betreft expliciet de subgroep mét beschikbare follow-up, omdat nog niet voor iedereen week 48 is verzameld. Samen genomen wijzen deze patronen op functionele winst die ook buiten vragenlijstscores zichtbaar wordt.
In de literatuur wordt post-COVID frequent in verband gebracht met autonome dysfunctie, waaronder een relatieve verschuiving richting hogere sympathische activatie en/of verminderde parasympathische (vagale) modulatie [12]. HRV—met name RMSSD als maat voor korte-termijn variabiliteit—wordt daarbij vaak gebruikt als niet-invasieve indicator van autonome regulatie. Eerder onderzoek in post-COVID patiënten laat zien dat door middel van interventies gericht op ademhaling, een verbetering in klachten en tegelijkertijd een hogere HRV score gezien wordt. Hoewel verder onderzoek een causale relatie tussen HRV en klachtenverbetering bij post-COVID aan moet tonen, past de in deze studie gevonden toename in HRV (RMSSD) mogelijk bij een verbetering van de autonome regulatie [13]. Tegelijk is interpretatie van absolute HRV-waarden en veranderingen sterk afhankelijk van meetcondities (o.a. slaap/waak, fysieke activiteit, ademhaling, medicatie, en dag-tot-dagvariatie). Het gebruik van drie aaneengesloten meetdagen op twee tijdspunten vermindert de invloed van toevallige dagfluctuaties, maar verdere studies met controlegroep zijn nodig om de klinische betekenis van de verandering en het verband met symptoomverbetering en functionele uitkomsten beter te duiden.
Relevante vergelijking van onze resultaten met andere behandelingen is beperkt, gezien het geringe aantal aanbieders, het schaarse gepubliceerde onderzoek naar neuroplasticiteitsgerichte behandelingen bij post-COVID en de heterogeniteit in behandelinhoud en uitkomstmaten.
De steekproef (n = 49; 71.4% vrouw; gem. leeftijd 41.5 jaar) representeert een populatie met heterogene achtergronden (gem. 2.2 jaar sinds COVID-19 besmetting). We zagen een lichte oververtegenwoordiging van hogeropgeleiden, wat de externe validiteit naar lageropgeleiden en sommige arbeidssectoren kan beperken. Variatie en personalisatie in programma-opbouw bemoeilijken bovendien het toeschrijven van effecten aan specifieke componenten.
Sterktes van dit onderzoek zijn (1) de combinatie van meerdere, conceptueel aanvullende uitkomsten (klachtlast, kwaliteit van leven, executieve functies, werkparticipatie, hartslagvariabiliteit), (2) proxy-beoordelingen die een extern perspectief geven, en (3) meervoudige follow-ups tot en met week 48–96 bij een deel van de deelnemers. Beperkingen zijn (1) het ontbreken van een controlegroep en randomisatie; (2) uitval en missende data op latere tijdspunten, wat risico op selectiebias en overschatting/onderschatting van effecten meebrengt; (3) test-hertest effecten, en (4) het gebruik van niet-gevalideerde vragenlijsten.
Onze resultaten tonen aan dat het merendeel van de personen met post-COVID die het neuroplasticiteitstraject volgden, substantiële en blijvende verbeteringen laat zien in symptoomlast en kwaliteit van leven, met parallelle winst in executieve functies en arbeidsparticipatie. Voor de klinische praktijk onderstreept dit het nut van multimodale trajecten die zowel somatische als gedragsmatige doelen adresseren, en het belang van gestructureerde follow-up met meerdere typen uitkomsten (klachten, functioneren, participatie).
Voor toekomstig onderzoek bevelen we aan: 1. Gerandomiseerde studies om causale verbanden aan te tonen tussen de interventie en vooruitgang op uitkomstmaten en werkzame elementen (bijv. fysieke training, cognitieve training, leefstijladvies, exposure) te isoleren. 2. Langere follow-up en systematische monitoring van werkparticipatie, inclusief documentatie van context (bijvoorbeeld sector). 3. Datakwaliteit: standaardisatie van programmaregistratie en subgroepen (bijv. psychologische profielen) om componentanalyses en dose–response-relaties mogelijk te maken. 4. Subgroep- en mechanisme-onderzoek (leeftijd, opleidingsniveau, tijd sinds besmetting, baseline-ernst, psychologische profielen) om te identificeren wie het meest profiteert en via welke routes.
In deze populatie zien we bij afsluiting van het behandeltraject in week 12 grote verbeteringen in symptoomlast (SCAT5), duidelijke winst in kwaliteit van leven (QOLIBRI) en consistente afname van executieve klachten (DEX, DEX-naaste), een verhoging van hartslagvariabiliteit (HRV), en gunstige trends in werkparticipatie. Deze bevindingen houden volgens de huidige data aan tot ten minste de middellange termijn. Door het ontbreken van een controlegroep vormen de resultaten geen direct bewijs voor behandel-effectiviteit, maar ze bieden bemoedigende aanknopingspunten voor gerichte, hypothesegedreven vervolgstudies naar de werkzame componenten en de mechanismen achter herstel bij post-COVID klachten.
4 Methoden
4.1 Behandeling
Het behandeltraject bij NeuroRC bestaat uit een aantal gefaseerde stappen waarin neuroplasticiteitstraining wordt gecombineerd met leefstijlinterventies. Het traject start met een uitgebreide intake door een BIG-geregistreerde zorgprofessional (psycholoog of arts). Tijdens dit gesprek wordt beoordeeld of het programma passend is voor de cliënt. De behandeling richt zich met name op mensen waarbij cognitieve klachten, zoals overprikkeling, concentratieproblemen of mentale vermoeidheid, op de voorgrond staan. Indien er uit de intake blijkt dat er sprake is van een (te) laag belastbaarheidsniveau en/of PEM-klachten dan wordt er gestart met een gepersonaliseerd voortraject.
4.1.1 Voortraject
Tijdens het voortraject worden diverse metingen uitgevoerd die gericht zijn op het identificeren van individuele, pathofysiologische factoren die het herstel bij persisterende post-COVID-klachten kunnen belemmeren. Onderdelen van deze testbatterij zijn een SARS-CoV-sporenonderzoek (bloed/speeksel) in combinatie met de bepaling van IDO-2, IL-6 en kynurenine, een darmmicrobioomonderzoek (DMB) en een driedaagse stressmeting (HRV). Aansluitend vindt een multidisciplinair overleg plaats met een GZ-psycholoog, sportpsycholoog, medisch microbioloog, (huis)arts, diëtist en fysiotherapeut. Mogelijke herstelbelemmerende factoren zijn onder meer virale persistentie, dysbiose of autonome dysregulatie. Op basis van de bevindingen worden individuele adviezen gegeven ter ondersteuning van het herstel voorafgaand aan de intensieve trainingsweek.
Ongeveer twee weken vóór de intensieve behandelweek worden voormetingen afgenomen om de beginsituatie van de cliënt in kaart te brengen. Deze baseline wordt bepaald aan de hand van vragenlijsten. In deze periode ontvangen cliënten tevens leefstijladviezen op het gebied van voeding, beweging, slaap, ademhaling en stressregulatie (waarbij gewerkt wordt met begrippen als stressmindset en groeimindset). De leefstijlveranderingen vormen een belangrijke voorbereiding op de training.
4.1.2 Neuroplasticiteitstraining
De kern van de behandeling is een intensieve neuroplasticiteitstraining, die plaatsvindt gedurende één week (vijf dagen, van 09:00 tot 16:00 uur), gevolgd door vier zogenoemde boostermomenten in de weken erna. Tijdens de trainingsweek wordt dagelijks een vaste cyclus doorlopen, bestaande uit drie fasen: Activatie, Breintraining en Consolidatie.
De activatiefase bestaat uit verschillende onderdelen: Ademhalingsoefeningen, fasciale stretches en een tot vier zeer korte intervallen van 5 tot 10 seconden op een hometrainer. De intervallen op de hometrainer worden gevolgd door een rustperiode van minimaal 5 minuten waarin gerichte ademhalingsoefeningen gebruikt worden om het herstel te bevorderen. Er wordt gebruikgemaakt van hartslag- en HRV registratie om het herstel te monitoren en om de dosering van de intervallen te bepalen.
De tweede fase, de breintraining, bestaat uit cognitieve en sensorimotorische oefeningen waarin het brein simultaan op meerdere domeinen wordt aangesproken — zoals balans, motoriek, auditieve en visuele verwerking, en werkgeheugen. Denk hierbij aan taken zoals balansoefeningen op een balansbal, gecombineerd met mentale rekentaken, terwijl muziek op de achtergrond speelt. De training is bewust uitdagend ontworpen: het maken van fouten en het omgaan met lichte frustratie zijn expliciet onderdeel van het proces. De intensiteit van de breintraining wordt aangepast aan de belastbaarheid van de cliënt.
In de consolidatiefase volgt een rustperiode van 60 minuten, waarin deelnemers gebruikmaken van ontspanningstechnieken in een prikkelarme ruimte. Ook hier wordt de HRV gemonitord om het herstellend vermogen na inspanning in kaart te brengen.

Gedurende het gehele traject is er intensieve begeleiding door een vast team van trainers en behandelaren. In totaal vinden vier evaluatiemomenten plaats: twee korte en twee uitgebreide gesprekken, waarin wordt geëvalueerd hoe het traject verloopt en in welke mate de nieuw aangeleerde vaardigheden worden toegepast in het dagelijks leven.
4.2 Meetmomenten
De dataverzameling vond plaats op vaste meetmomenten (Tabel 6), waarvan de intensieve behandelweek (uitgevoerd in week 3 van het traject) het referentiepunt vormt. In figuren en tabellen hanteren we de notatie +1 week, +9 weken, +5 maanden, +1 jaar en +2 jaar om deze meetmomenten aan te duiden, steeds ten opzichte van de behandelweek in week 3.
| Tijd.t.o.v..behandelweek | Meetweek | Omschrijving |
|---|---|---|
| –2 weken | Week 1 | Baseline |
| +1 week | Week 4 | 1 week na de intensieve behandelweek |
| +9 weken | Week 12 | Officiële afsluiting traject |
| +~5 maanden | Week 24 | Follow-up |
| +~1 jaar | Week 48 | Follow-up |
| +~2 jaar | Week 96 | Langetermijn follow-up |
4.3 Meetinstrumenten
De karakteristieken en het functioneren van de deelnemers werden geëvalueerd aan de hand van herhaalde vragenlijsten en multidisciplinaire metingen (zie Figuur 1). Deze omvatten de volgende componenten:
Intakevragenlijst: Deze vragenlijst werd afgenomen om gedetailleerde informatie te verzamelen over de demografische en medische achtergrond van de deelnemers, inclusief relevante persoonskenmerken en specifieke kenmerken van hun hersenletsel.
Symptoomlast: De symptoomlast werd gekwantificeerd met behulp van de Sports Concussion Assessment Tool – 5th edition (SCAT5).
Kwaliteit van leven: De kwaliteit van leven van de deelnemers werd gemeten met de Quality of Life after Brain Injury (QOLIBRI) vragenlijst.
Werkgerelateerd functioneren: Het werkgerelateerd functioneren werd geëvalueerd met de Work Ability Index (WAI).
4.3.1 Work Ability Index (WAI)
De afgenomen versie van de WAI bestond uit zes vragen, waarmee de volgende dimensies van werkvermogen werden bevraagd:
Is je beroep fysiek belastend (veel staan/lopen), mentaal belastend (zittend beroep) of beide?
Hoeveel punten zou je dan geven aan je huidig werkvermogen? (0 betekent dat je momenteel helemaal niet kan werken)
Hoe schat jij jouw huidig werkvermogen in ten aanzien van de fysieke vereisten van je werk?
Hoe schat jij jouw huidig werkvermogen in ten aanzien van de mentale vereisten van je werk?
Hoeveel uren werk je op dit moment per week?
Hoeveel uur werkte je voordat je ziek werd?
Voor de analyse zijn de ruwe gegevens opgeschoond: tekstuele of open antwoorden in intervalvorm, zoals 36–40, werden omgerekend naar het midden van het bereik (in dit geval 38). Antwoorden als 40+ zijn als maximale waarde geïnterpreteerd en geconverteerd naar 40. Alle scores zijn vervolgens omgezet naar numerieke waarden voor verdere analyse.
5 Bijlagen
5.1 Subgroep cliënten met geldige SCAT5-voormeting en -nameting
| Subcategorie | Eigenschap | Niveau | N (%) | Gemiddelde (SD) |
|---|---|---|---|---|
| Demografische gegevens | Geslacht | Vrouwelijk | 27 (75%) | |
| Mannelijk | 9 (25%) | |||
| Leeftijd bij start behandeling | 36 (100%) | 41.5 (12.0) | ||
| Opleidingsniveau | Hbo-, wo-bachelor | 10 (27.8%) | ||
| Onbekend | 9 (25%) | |||
| Havo, vwo, mbo2-4 | 8 (22.2%) | |||
| Hbo-, wo-master, doctor | 8 (22.2%) | |||
| Vmbo, havo-, vwo-onderbouw, mbo1 | 1 (2.8%) | |||
| Kenmerken Post-Covid | Type | Post Covid | 27 (75%) | |
| Onbekend | 9 (25%) | |||
| Jaren sinds besmetting | 23 (63.9%) | 2.3 (1.5) | ||
| Subdiagnose | Onbekend | 21 (58.3%) | ||
| DSQ score wijzend op PEM | 12 (33.3%) | |||
| DSQ score niet wijzend op PEM | 2 (5.6%) | |||
| Chronisch vermoeidheidssyndroom (ME/CVS) | 1 (2.8%) | |||
| Behandeling | Behandeling NeuroRC | Onbekend | 19 (52.8%) | |
| Intensieve week + boosterdagen | 12 (33.3%) | |||
| Intensieve week + mHBOT + boosterdagen | 5 (13.9%) | |||
| Behandelgeschiedenis | Gevolgde behandelingen | Onbekend | 29 (80.6%) | |
| Eerste lijns fysiotherapie | 3 (8.3%) | |||
| Behanding bij een 2e lijns GGZ instelling of psychiater | 2 (5.6%) | |||
| Eerste lijns ergotherapie | 2 (5.6%) | |||
| Eerste lijns psycholoog | 1 (2.8%) | |||
| Revalidatie poliklinisch | 1 (2.8%) |
5.2 Subgroep cliënten met geldige QOLIBRI-voormeting en -nameting
| Subcategorie | Eigenschap | Niveau | N (%) | Gemiddelde (SD) |
|---|---|---|---|---|
| Demografische gegevens | Geslacht | Vrouwelijk | 28 (71.8%) | |
| Mannelijk | 11 (28.2%) | |||
| Leeftijd bij start behandeling | 39 (100%) | 42.0 (12.0) | ||
| Opleidingsniveau | Hbo-, wo-bachelor | 13 (33.3%) | ||
| Havo, vwo, mbo2-4 | 9 (23.1%) | |||
| Hbo-, wo-master, doctor | 9 (23.1%) | |||
| Onbekend | 7 (17.9%) | |||
| Vmbo, havo-, vwo-onderbouw, mbo1 | 1 (2.6%) | |||
| Kenmerken Post-Covid | Type | Post Covid | 27 (69.2%) | |
| Onbekend | 12 (30.8%) | |||
| Jaren sinds besmetting | 28 (71.8%) | 2.1 (1.4) | ||
| Subdiagnose | Onbekend | 28 (71.8%) | ||
| DSQ score wijzend op PEM | 9 (23.1%) | |||
| Chronisch vermoeidheidssyndroom (ME/CVS) | 1 (2.6%) | |||
| DSQ score niet wijzend op PEM | 1 (2.6%) | |||
| Behandeling | Behandeling NeuroRC | Onbekend | 20 (51.3%) | |
| Intensieve week + boosterdagen | 10 (25.6%) | |||
| Intensieve week + mHBOT + boosterdagen | 9 (23.1%) | |||
| Behandelgeschiedenis | Gevolgde behandelingen | Onbekend | 32 (82.1%) | |
| Eerste lijns fysiotherapie | 4 (10.3%) | |||
| Eerste lijns ergotherapie | 3 (7.7%) | |||
| Behanding bij een 2e lijns GGZ instelling of psychiater | 1 (2.6%) | |||
| Eerste lijns psycholoog | 1 (2.6%) | |||
| Revalidatie poliklinisch | 1 (2.6%) |
5.3 Subgroep cliënten met geldige WAI-voormeting en -nameting
| Subcategorie | Eigenschap | Niveau | N (%) | Gemiddelde (SD) |
|---|---|---|---|---|
| Demografische gegevens | Geslacht | Vrouwelijk | 24 (64.9%) | |
| Mannelijk | 13 (35.1%) | |||
| Leeftijd bij start behandeling | 37 (100%) | 42.0 (12.1) | ||
| Opleidingsniveau | Hbo-, wo-bachelor | 14 (37.8%) | ||
| Hbo-, wo-master, doctor | 9 (24.3%) | |||
| Havo, vwo, mbo2-4 | 8 (21.6%) | |||
| Onbekend | 6 (16.2%) | |||
| Kenmerken Post-Covid | Type | Post Covid | 26 (70.3%) | |
| Onbekend | 11 (29.7%) | |||
| Jaren sinds besmetting | 26 (70.3%) | 2.2 (1.4) | ||
| Subdiagnose | Onbekend | 28 (75.7%) | ||
| DSQ score wijzend op PEM | 6 (16.2%) | |||
| DSQ score niet wijzend op PEM | 2 (5.4%) | |||
| Chronisch vermoeidheidssyndroom (ME/CVS) | 1 (2.7%) | |||
| Behandeling | Behandeling NeuroRC | Onbekend | 21 (56.8%) | |
| Intensieve week + mHBOT + boosterdagen | 9 (24.3%) | |||
| Intensieve week + boosterdagen | 7 (18.9%) | |||
| Behandelgeschiedenis | Gevolgde behandelingen | Onbekend | 31 (83.8%) | |
| Eerste lijns ergotherapie | 3 (8.1%) | |||
| Eerste lijns fysiotherapie | 3 (8.1%) | |||
| Behanding bij een 2e lijns GGZ instelling of psychiater | 2 (5.4%) | |||
| Eerste lijns psycholoog | 2 (5.4%) |
5.4 Subgroep cliënten met geldige DEX-voormeting en -nameting
| Subcategorie | Eigenschap | Niveau | N (%) | Gemiddelde (SD) |
|---|---|---|---|---|
| Demografische gegevens | Geslacht | Vrouwelijk | 8 (72.7%) | |
| Mannelijk | 3 (27.3%) | |||
| Leeftijd bij start behandeling | 11 (100%) | 43.1 (9.7) | ||
| Opleidingsniveau | Hbo-, wo-bachelor | 4 (36.4%) | ||
| Havo, vwo, mbo2-4 | 2 (18.2%) | |||
| Hbo-, wo-master, doctor | 2 (18.2%) | |||
| Onbekend | 2 (18.2%) | |||
| Vmbo, havo-, vwo-onderbouw, mbo1 | 1 (9.1%) | |||
| Kenmerken Post-Covid | Type | Post Covid | 9 (81.8%) | |
| Onbekend | 2 (18.2%) | |||
| Jaren sinds besmetting | 9 (81.8%) | 3.0 (1.9) | ||
| Subdiagnose | DSQ score wijzend op PEM | 7 (63.6%) | ||
| Onbekend | 2 (18.2%) | |||
| Chronisch vermoeidheidssyndroom (ME/CVS) | 1 (9.1%) | |||
| DSQ score niet wijzend op PEM | 1 (9.1%) | |||
| Behandeling | Behandeling NeuroRC | Intensieve week + boosterdagen | 8 (72.7%) | |
| Onbekend | 3 (27.3%) | |||
| Behandelgeschiedenis | Gevolgde behandelingen | Onbekend | 7 (63.6%) | |
| Eerste lijns fysiotherapie | 2 (18.2%) | |||
| Behanding bij een 2e lijns GGZ instelling of psychiater | 1 (9.1%) | |||
| Eerste lijns ergotherapie | 1 (9.1%) | |||
| Revalidatie poliklinisch | 1 (9.1%) |
5.5 Subgroep cliënten met geldige DEX-naaste-voormeting en -nameting
| Subcategorie | Eigenschap | Niveau | N (%) | Gemiddelde (SD) |
|---|---|---|---|---|
| Demografische gegevens | Geslacht | Vrouwelijk | 5 (71.4%) | |
| Mannelijk | 2 (28.6%) | |||
| Leeftijd bij start behandeling | 7 (100%) | 44.9 (9.6) | ||
| Opleidingsniveau | Hbo-, wo-bachelor | 2 (28.6%) | ||
| Hbo-, wo-master, doctor | 2 (28.6%) | |||
| Havo, vwo, mbo2-4 | 1 (14.3%) | |||
| Onbekend | 1 (14.3%) | |||
| Vmbo, havo-, vwo-onderbouw, mbo1 | 1 (14.3%) | |||
| Kenmerken Post-Covid | Type | Post Covid | 6 (85.7%) | |
| Onbekend | 1 (14.3%) | |||
| Jaren sinds besmetting | 6 (85.7%) | 3.0 (2.3) | ||
| Subdiagnose | DSQ score wijzend op PEM | 5 (71.4%) | ||
| Chronisch vermoeidheidssyndroom (ME/CVS) | 1 (14.3%) | |||
| Onbekend | 1 (14.3%) | |||
| Behandeling | Behandeling NeuroRC | Intensieve week + boosterdagen | 4 (57.1%) | |
| Onbekend | 3 (42.9%) | |||
| Behandelgeschiedenis | Gevolgde behandelingen | Eerste lijns fysiotherapie | 3 (42.9%) | |
| Onbekend | 3 (42.9%) | |||
| Behanding bij een 2e lijns GGZ instelling of psychiater | 1 (14.3%) | |||
| Eerste lijns ergotherapie | 1 (14.3%) |
5.6 Subgroep cliënten met geldige HRV-voormeting en -nameting
| Subcategorie | Eigenschap | Niveau | N (%) | Gemiddelde (SD) |
|---|---|---|---|---|
| Demografische gegevens | Geslacht | Vrouwelijk | 20 (69%) | |
| Mannelijk | 9 (31%) | |||
| Leeftijd bij start behandeling | 29 (100%) | 43.0 (11.8) | ||
| Opleidingsniveau | Hbo-, wo-bachelor | 11 (37.9%) | ||
| Havo, vwo, mbo2-4 | 7 (24.1%) | |||
| Hbo-, wo-master, doctor | 6 (20.7%) | |||
| Onbekend | 4 (13.8%) | |||
| Vmbo, havo-, vwo-onderbouw, mbo1 | 1 (3.4%) | |||
| Kenmerken Post-Covid | Type | Post Covid | 20 (69%) | |
| Onbekend | 9 (31%) | |||
| Jaren sinds besmetting | 21 (72.4%) | 2.0 (1.0) | ||
| Subdiagnose | Onbekend | 25 (86.2%) | ||
| DSQ score niet wijzend op PEM | 2 (6.9%) | |||
| DSQ score wijzend op PEM | 2 (6.9%) | |||
| Behandeling | Behandeling NeuroRC | Onbekend | 20 (69%) | |
| Intensieve week + mHBOT + boosterdagen | 8 (27.6%) | |||
| Intensieve week + boosterdagen | 1 (3.4%) | |||
| Behandelgeschiedenis | Gevolgde behandelingen | Onbekend | 26 (89.7%) | |
| Eerste lijns fysiotherapie | 2 (6.9%) | |||
| Eerste lijns psycholoog | 2 (6.9%) | |||
| Behanding bij een 2e lijns GGZ instelling of psychiater | 1 (3.4%) | |||
| Eerste lijns ergotherapie | 1 (3.4%) |
Bronnen
Citaat
@online{theeuwes2026,
author = {Theeuwes, Bente and Koster-Top, Rosanne and Doornbos,
Adriaan},
title = {Effectiviteit van een neuroplasticiteitsbehandeling bij
post-COVID},
date = {2026-01-21},
langid = {nl},
abstract = {**Achtergrond**: Post-COVID gaat vaak gepaard met
aanhoudende cognitieve en fysieke klachten die het dagelijks
functioneren belemmeren. NeuroRC ontwikkelde een
neuroplasticiteitstraining voor mensen met post-COVID.
**Doelstelling:** Deze studie onderzocht de effectiviteit van het
behandelprogramma bij individuen met post-COVID klachten op het
gebied van symptoomlast, kwaliteit van leven, executief
functioneren, werkvermogen, en hartslagvariabiliteit. **Methode:**
In totaal namen 49 cliënten met post-COVID deel aan het programma.
Voor en na de interventie werden meerdere vragenlijsten afgenomen,
waaronder de SCAT5 Symptoomevaluatie, Quality of Life after Brain
Injury (QOLIBRI), de Work Ability Index (WAI) en het executief
functioneren (DEX). Daarnaast werd de hartslagvariabiliteit (HRV)
gemeten. Veranderingen in symptoomlast en functioneren werden
geëvalueerd met behulp van gepaarde t-toetsen en effectgroottes. Dit
betreft een tussentijdse analyse van een lopend onderzoek;
behandelingen en dataverzameling zijn nog gaande. **Resultaten:** De
gemiddelde symptoomernst nam significant af tussen baseline en week
12 (gemiddelde afname: -34.4 punten; p \textless{} .001, Cohen’s d =
-1.92). Op de QOLIBRI werd eveneens een significante verbetering
waargenomen: de gemiddelde totaalscore steeg van 48.6 bij baseline
naar 69.6 in week 12 (gemiddeld verschil = 21 punten; p \textless{}
.001, Cohen’s d = 1.47). Deelnemers werkten voorafgaand aan de
behandeling gemiddeld 10.6 uur per week; circa één jaar na het
traject was dit toegenomen tot gemiddeld 19.9 uur per week.
**Conclusie:** Het behandelprogramma van NeuroRC laat veelbelovende
effecten zien op symptoomvermindering en dagelijks functioneren bij
cliënten met post-COVID. Deze resultaten onderstrepen het potentieel
van intensieve, neuroplasticiteitsgerichte interventies voor deze
doelgroep.}
}